 |
Başlıklar |
|
 
Akut Miyeloid Lösemi
“Diş eti ve burun kanaları, deride küçük kırmızı döküntüler, ateş ve kansızlık akut lösemilerde sık görülen belirtilerdir.”
AKUT LÖSEMİLER
Lösemi nedir?
Kan kanseri olarak adlandırılan lösemi, kemik iliğinin anormal hücreler ile dolması ve bu hücrelerin kana ve tüm dokulara yayılması sonucu belirti veren malign (kötü huylu) bir hastalıktır. Akut lösemi ani başlar ve tedavi edilmezse kısa sürede ölüme yol açar.
Belirtileri nedir?
Kan pıhtılaşmasında rol oynayan trombositler ve enfeksiyonlara karşı savunmada rol oynayan lökositlerin sayısı azalmaya başlar. Trombosit düşüklüğü hastalarda morluk oluşumuna, deri ve burun kanamalarına yol açarken, lökosit düşüklüğü yüksek ateş ve kolay enfeksiyon görülmesine neden olur. Kırmızı kan hücresi eksikliği anemiye ve buna bağlı olarak , halsizliğe, nefes darlığına, kolay yorulmaya neden olur. Bunun dışında kilo kaybı, dişetlerinde şişkinlik ve eklem ağrıları görülebilir.
Lösemiler nasıl sınıflandırılır?
Lösemiler akut veya kronik olarak sınıflandırılırlar. Genel olarak, akut lösemiler çocuklarda ortaya çıkarken, kronik lösemiler daha çok yetişkinlerde görülme eğilimindedirler. Löseminin hücre tipine göre miyeloid ve lenfoid olmak üzere ikiye ayrılır.
Akut Miyeloid Lösemi (AML) nedir? 
Lökositleri meydana getiren hücrelerden granülosit ve monositler kemik iliğindeki blast adı verilen genç hücrelerin basamak basamak olgunlaşması sonucu oluşurlar. Meydana gelen bu olgun hücreler blastların aksine fonksiyon gören hücreler olup mikroplarla mücadele eder ve bağışıklık sisteminde rol oynarlar.
Akut miyeloid lösemide, normal olgunlaşma süreci bozulur, blast adı verilen genç hücreler olgunlaşamaz, kemik iliği ile kanda birikmeye başlarlar. Nötrofil, monosit gibi olgun hücreler meydana gelemediğinden mikroplara karşı vücut savunmasız kalır. Miyeloblastların anormal çoğalması sonucu kemik iliğinde eritrosit ve trombosit yapımı bozulur. Buna bağlı olarak anemi ve trombosit sayısında azalma meydana gelir.
Nedeni nedir? 
Kesin nedenleri bilinmemekle birlikte hem genetik hem de çevresel faktörlerin önemli rol oynadığı düşünülmektedir. Genlerde oluşan değişikliklerin (mutasyon, translokasyon) bazıları lösemi gelişimine yol açan genleri uyarırken, bazıları da lösemi oluşmasını engelleyen genlerin fonksiyonunu bozarak lösemi gelişimine neden olurlar. Genetik sebeplerin dışında lösemi gelişimine neden olan çevresel faktörler şunlardır:
- Yüksek doz radyasyona maruz kalma: Özellikle 2. Dünya Savaşı’nda Japonya’ya atom bombası atıldıktan sonra bu bölgede yaşayanlarda lösemi görülme oranı artmıştır.
- Kimyasal maddeler: Özellikle benzen gibi kimyasal maddelere maruz kalanlarda ve sigara kullananlarda lösemi sıklığı artar.
- Bazı doğumsal hastalıklar: Down sendromu, Fanconi anemisi gibi kalıtsal hastalıklar ile miyelodisplastik sendrom, polisitemia vera gibi edinsel hastalıklarda lösemi sıklığı artar.
- Bazı kemoterapi ilaçları: lenfoma, yumurtalık kanseri, meme kanseri gibi hastaların tedavisinde kullanılan bazı kemoterapi ilaçları lösemi görülme sıklığını arttırır.
- Virüsler
Belirtiler 
Hastaların çoğunda daha önce belirgin bir sağlık sorunu yok iken haftalar hatta günler içinde artan rahatsızlık hissi vardır. Anemiye bağlı olarak halsizlik, çabuk yorulma, fiziksel aktivite sırasında nefes darlığı oluşur. Trombosit sayısı sıklıkla düşük olduğundan vücutta morluklar, toplu iğne başı büyüklüğünde yaygın kırmızı döküntüler, dişeti, burun kanaması meydana gelir. Ateşe, cilt, solunum yolu ve boğaz enfeksiyonlarına sıklıkla rastlanır, bazen diş etlerinde şişlik görülür. İştahsızlık sıktır, kilo kaybı görülebilir.
Tanı 
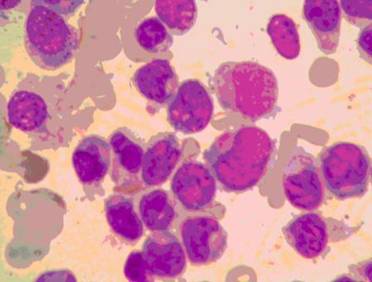
Kan sayımında anemi ve trombosit sayısında düşüklük sıktır. Lökosit sayısı artmış azalmış veya normal olabilir. Çevre kanından hazırlanan yaymada blastların görülmesi tanıyı kuvvetlendirir. Kemik iliği biyopsisinde veya çevre kanı yaymasında blast sayısının %20’nin üzerinde olması akut lösemi tanısı koydurur (Şekil). Löseminin tipi (AML-ALL) ve AML’nin alt grup tayini, akım sitometrisi yardımıyla ve özel boyalarla boyanan kemik iliği biyopsisinin mikroskopik incelenmesi sonucu yapılır. Hastadan alınan ilik örneği kromozom incelemesine gönderilir. Genç ve kardeşi olan hastalarda olası ilik nakli için doku uygunluk testleri (HLA) yapılmalıdır.
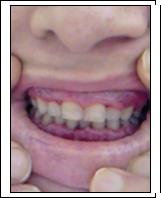
Şekil: AML’de dişeti tutulumu
Şekil - AML de miyeloblastlar
Tipleri nelerdir? 
AML ve miyeloid neoplazilerin WHO (Dünya Sağlık Örgütü) 2008 sınıflaması:
- Tekrarlayan genetik bozuklukla olan AML t(8:21), t(15:17), inv(16), t(9;11), t(6;9), inv(3), megakaryoblastik t(1;22).
- Miyelodisplazi ilişkili değişikliklerle olan AML
- Tedavi ilişkili miyeloid neoplaziler
- Sınıflandırılamayan grup (M0, M1, M2, M4, M5, M6 M7), akut bazofilik lösemi, miyelofibrozlu akut panmiyeloz.
- Miyeloid sarkom
- Down Sendromu ilişkili miyeloid proliferasyonlar
- Blastik plazmasitoid dendritik hücre neoplazileri
Tip tayini neden yapılır? 
Alt grup tayini hastaya uygun tedavi seçeneklerinin belirlenmesinde önemli faktörlerden biridir. Bazı kromozom bozukluğu olan gruplarda, hastaların önemli bir kısmında sadece kemoterapi ile şifa sağlanır. Bu hastalarda kemik iliği nakli ilk seçenek değildir. Kemoterapi sonrası veya birden fazla seride displazi olan grupta ise sadece kemoterapi yeterli olamamaktadır. Bu hastalara, uygun vericileri var ise kök hücre nakli yapılmalıdır.
Prognoz ve önemi nedir? 
Prognoz hastalığın nasıl seyredeceğinin öngörüsüdür. Bu kriterlere göre hastaya ilaç tedavisi veya daha ağır tedavilerle kemik iliği nakli yapılıp yapılmayacağına karar verilir.
AML’de prognostik faktörler 
Hasta kişiye uygun tedavi seçeneklerinin belirlenmesinde blastik hücrelerin genetik yapısı önemlidir. Bazı genetik bozukluklar hasta lehine iken bazıları ise aleyhinedir. Diğer önemli faktör ise hastanın yaşıdır. Hastaların tedavisinde belli standart yaklaşımlar olmakla beraber tedavi kişiden kişiye değişir. Blastik hücrelerdeki kötü genetik yapı, tek kemoterapi ile remisyona girmeme, çok yüksek lökosit sayısı, ileri yaşlı hastalar, yüksek risk grubunda yer alırlar. Bu gruptaki hastalarda sadece kemoterapi ile şifa sağlamak çok zordur. Uygun hastalarda mutlaka kemik iliği nakli yapılması gerekir. Buna karşın, iyi sitogenetik bozuklukları olan [ t(15:17), t(8:21), inv16 ] ve remisyona giren hastalarda sadece kemoterapi ile yapılan pekiştirme tedavisi ile hastaların önemli bir kısmında şifa elde edilir. Bu grup hastalarda kök hücre nakli, pekiştirme tedavisi olarak ilk seçenek değildir. Bu iki grup dışındaki hastalara standart riskli hastalar denir. Orta riskli hastalarda yakın zamana kadar uygulanacak pekiştirme tedavisi merkezlere göre değişiklik göstermekteydi. Ancak son birkaç yıl içinde FLT3, NPM1, CEBPA gibi yeni genetik anormallikler saptandı ve bu genetik bozuklukların hastaların tedaviye yanıtı ve şifa elde edilip edilemeyeceğini göstermesi açısından çok önemli olduğu anlaşıldı. FLT3 + olan hastalarda pekiştirme tedavisi olarak kemoterapi yetersiz kaldığından, remisyon sonrası kemik iliği nakli yapılması gerekir. Ancak CEPBA, NPM1 + olan ve FLT3 - olan hastalarda ise sadece kemoterapi yeterli olmaktadır.
Remisyon nedir? 
Remisyon, lösemik blastların kan ve kemik iliğinden kaybolması ve kemik iliğinin normal yapı ve fonksiyonunu kazanması demektir. Remisyondaki bir hastanın belirgin bir yakınması kalmaz ve kan sayımları normal bulunur. Tam remisyon sağlanması için hastaların önemli bir kısmında yoğun bir kemoterapi uygulanması gerekir.
Remisyon indüksiyon tedavisi nedir? 
AML'de tedavi, remisyon indüksiyonu ve pekiştirme tedavisi olmak üzere 2 bölümden oluşur.Remisyon sağlanması için yapılan tedaviye remisyon indüksiyon tedavisi denir. Şifa sağlamak için hastaların mutlaka önce remisyona girmesi gerekir. Remisyona giren hastalara pekiştirme tedavisi verilir. Remisyon indüksiyon tedavisi olarak genellikle birden fazla kemoterapik ilaç, birlikte veya ardışık olarak uygulanır. En sık kullanılan ilaçlarlar şunlardır: Sitozin arabinozid ile daunarubisin veya idarubisindir. En sık kullanılan rejimde sitozin arabinozid genellikle 7 gün sürekli olarak damar yoluyla verilirken, daunarubisin veya idarubisin 3 gün üst üste kısa süreli damardan verilir buna 3+7 rejimi denir. Ancak bazı merkezlerde bu rejimin değişik tipleri kullanılır. Sitozin arabinozid 7 yerine 10 gün süreyle verilebilir veya çok daha yüksek dozlarda kullanılabilir. Bazı merkezlerde Etopozid gibi ilaçlar ilave olarak verilebilir. Son yıllarda anti CD 33 antikoru, 5-azacitidine ve clofarabine kullanılmaya başlanmıştır. Bu ilaçların sitozin arabinozit ve daunarubisin veya idarubisin ile kombinasyonları ile başarılı sonuçlar bildirilmeye başlanmıştır.
Remisyon tedavisinde nelere dikkat edilir? 
Bu tedavi ile lösemik blastlar öldürülürken normal hücreler de zarar görür. Tedavi sırasında anemi, trombosit düşüklüğü ve lökopeni görülür. Trombositopeniye bağlı olarak kanama ile lökopeniye bağlı enfeksiyon sık görülür. Trombositler düştüğünde hastalarda kolay kanama oluşacağından kalçadan iğne yaptırmaması, diş fırçalamaması ve erkek hastaların jiletle traş olmaması gerekebilir. Trombositleri düşük hastalara trombosit verilmesi gerekebilir. Bunun için uygun vericiler, aferez cihazı adı verilen aletlere bağlanarak trombosit süspansiyonları hazırlanır. Trombosit verilmesinin vericiye bir zararı yoktur. Bakteriler mantarlar ve daha az oranda da viruslar enfeksiyon etkenidir. Hastaları enfeksiyondan korumak için hasta yakınları özelllikle bu dönemde çok dikkatli olmalıdırlar. Hasta olan veya halsızlik, kırgınlık, burun akıntısı, boğaz ağrısı gibi hastalık bulguları taşıyanlar hasta ziyaretine gitmemelidirler. Yine bu dönemde, hastanede verilen veya izin verilen yiyecek ve içeçek dışında hastaya bir şey verilmemelidir. Enfeksiyon için güçlü antibiyotikler kullanılır. Bazı hastalar enfeksiyon nedeniyle bu dönemde kaybedilebilirler. Tedavi sonrası iyileşme için genellikle 4 haftalık bir periyoda ihtiyaç duyulur. Remisyon indüksiyon için bir veya iki kez kemoterapi rejimi verilebilir. Tedavi mutlaka hastaneye yatırılarak yapılmalıdır. Bu tedavi sonrası hastaların önemli bir kısmı remisyona girer. Ancak bu remisyon süresi genellikle kısa olduğunda ilave tedaviye ihtiyaç duyulur. Remisyon sonrası verilen bu tedaviye pekiştirme (konsolidasyon) tedavisi denir.
Remisyon sonrası tedavi (Pekiştirme tedavisi) nedir? 
Remisyon süresi kısa olduğundan ve ilave tedavi verilmezse hastaların hemen hepsi nüks edeceğinden remisyon sağlanan hastalarda ilave tedaviye ihtiyaç duyulur. Bu ilave tedaviye pekiştirme tedavisi denir. Pekiştirme tedavisi ya ilave kemoterapi verilerek ya da kemik iliği nakli ile yapılır. Kemik iliği nakli, doku uyumlu akrabadan (allojenik kemik iliği nakli) veya kişinin kendisinden (otolog kemik iliği nakli) yapılır.
İlave kemoterapi olarak remisyon sağlanması için verilen kemoterapi bir veya daha fazla kez tekrarlanır veya farklı kemoterapi rejimleri kullanılabilir. Pekiştirme tedavisi olarak genç hastalarda sıklıkla yüksek doz sitozin arabinozid (6gr/m²/gün, 3 gün süreyle) verilir.
Hastanın risk grubuna göre hangi tedavinin verileceğine (kemik iliği nakli veya kemoterapi) karar verilir. İyi risk grubunda ilave kemoterapi ile pekiştirme tedavisi yapılırken kötü risk grubunda kemik iliği nakli yapılmaktadır.
Pekiştirme tedavisinden başka AML’de, ALL de olduğu gibi 2-3 yıl süren idame tedavisi yapılmaz.
Akut promyelositik lösemi 
AML’nin bir alt grubu olan akut promyelositik lösemi (AML M3) diğer alt gruplardan farklıdır. Bu hastalarda sıklıkla kanama bulguları ön plandadır. Lökosit sayısı çok yüksek değildir. On beş ve 17. kromozomlar arasında translokasyon denen bir anormallik vardır. Bu anormalliğin saptanması hem tanı konulmasında hem de tedavinin etkinliğinin saptanmasında önemlidir. Kemoterapi ve ATRA ile hastaların önemli bir bölümünde şifa elde edilir. ATRA kemoteropatik bir ilaç değildir, bir çeşit A vitamini preparatıdır. Kemik iliğinde baskılanmaya neden olmadan remisyon oluşturur. Bu tedavi ile çok başarılı sonuçlar alındığı için kemik iliği nakli tercih edilmez, çünkü şifa oranları çok yüksektir. Bu tip lösemi tedavisinde arsenik de oldukça etkilidir. Remisyona giren hastalarda genellikle 3-4 kez pekiştirme tedavisi verilir. Pekiştirme tedavisi ile vücutta kalan çok az sayıdaki blastların ölmesi amaçlanır. Pekiştirme tedavisini idame tedavisi izler. İdame tedavisi akut lenfoblastik lösemideki idame tedavisine çok benzer ve genellikle 2 yıl kadar devam eder.
Kemik iliği (kök hücre) nakli nasıl yapılır? 
Hastaya çok yüksek doz kemoterapi ve/veya radyoterapi verilerek lösemik hücrelerin öldürülmesi amaçlanır. Ancak bu sırada normal hücreler de zarar görür. Kemik iliğinin yeniden kan yapabilmesi için hematopoyetik kök hücrelere ihtiyaç vardır. Bu kök hücreler ya hastadan tedavi öncesi özel işlemlerle toplanır (otolog kemik iliği) ya da doku uyumlu kardeşten veya akraba dışı kaynaklardan elde edilir (allojenik kemik iliği). İlk yıllarda hematopoyetik kök hücreler anestezi yardımıyla kalça kemiğinden biyopsi yapılır gibi toplanırdı. Ancak son yıllarda bu hücreler önce ilaçlar yardımıyla kemik iliğinden dolaşan kana çıkmaları sağlandıktan sonra, aferez adı verilen özel aletler yardımıyla damardan toplanmaya başlanmıştır.
Allojenik ve otolog kök hücre naklinde yüksek doz kemoterapi veya radyoterapi ile lösemik hücrelerin ölmesi sağlanır. Ayrıca allojenik kök hücre naklinde, buna ilaveten, vericinin bağışıklık hücrelerinin lösemik hücreleri tanıyarak öldürme etkisi vardır. Bu ikinci etki mekanizması allojenik kemik iliği naklinin otolog kemik iliği naklinden daha etkili olmasını sağlar.
Ancak allojenik nakilde rol oynayan bağışıklık hücreleri lösemik hücrelerin yanı sıra normal hücreleri de öldürdüğünden, bu tip naklin otolog nakle göre yan etkisi daha fazladır. Özellikle cilt ve sindirim sisteminde (bağırsaklar ve karaciğer) önemli hastalık tablosu oluşabilir (graft versus host hastalığı). Bu nedenle allojenik kemik iliği nakli genç ve başka sağlık problemi olmayan uygun hastalarda yapılır.
Kemik iliği nakli hangi hastalara yapılmalıdır? 
Kemik iliği nakli yan etkileri fazla olduğundan tüm AML’li hastalarda önerilen bir tedavi şekli değildir. Ancak remisyon sonrası hastalığı yineleyen (nüks), remisyon tedavisine yanıt alınamayan ve yüksek riskli grupta, hastanın uygun vericisi varsa allojenik nakil yapılmalıdır.
Nakil yapacak merkezin deneyimine göre orta riskli hasta grubunda da allojenik kemik iliği nakli yapılabilir. Özellikle bu grup hastalarda, son yıllarda saptanan FLT3 + ise kök
hücre nakli yapılmalıdır.
Remisyona giren hastaların takibi nasıl olmalı? 
Remisyona giren hastalar tıbbi takibe girerler; bunun nedeni özellikle ilk yıllarda hastalığın nüks etme oranının yüksek olmasıdır. Bu nedenle izlemde, aylık kan sayımları, fizik muayene yapılmalı ve her 3-6 ayda bir kemik iliği biyopsisi yapılarak incelenmelidir. Beş yıl süreyle remisyonda kalan hastalarda şifa sağlanmıştır, hastalık genellikle nüks etmez.
Yaşlı hastalarda tedavi 
AML olgularının ¾’ü 60 yaşın üzerindedir. Görülme sıklığı 75 yaştan sonra artar. Bu yaş grubunda MDS’yi takiben lösemi gelişimi veya kötü sitogenetik bozukluklar gibi kötü prognostik belirteçlere daha sık rastlanır.Genel durumun kötü oluşu veya eşlik eden organ bozuklukları nedeni ile tedavi çoğu kez yapılamaz. Standart kemoterapiye uygun olmayan hastalara düşük doz kemoterapi veya destek tedavisi verilir. Destek tedavisi olarak, trombosit ihtiyacı olduğunda trombosit süspansiyonu, enfeksiyon halinde uygun antibiyotik tedavisi veya kansızlık halinde gerektiğinde eritrosit süspansiyonu verilir. Azaltılmış yoğunluktaki kemoterapiler (örneğin düşük doz sitarabin 21 gün süre ile cilt altı) veya son yıllarda azasitidin gibi yeni geliştirilen ilaçlar tedavide kullanılmaya başlanmıştır. Kemoterapiye uygun hastalar genç hastalar gibi tedavi edilir.
AML / ALL’de Dikkat Edilmesi Gereken Hususlar 
Akut lösemi tedavisinde kullanılan kemoterapik ilaçlar kemik iliğini baskıladıkları için kemoterapi sırasında hastaların eritrosit, trombosit süspansiyonuna ihtiyaçları olur. Trombosit süspansiyonlarının hazırlanması için gönüllü vericilerin temininde hasta yakınlarından yardım istenebilir. Bu dönemde hastaların lökositleri de düştüğü için mikroplara karşı daha duyarlı hale gelirler. Bu yüzden lökositlerin düşük olduğu dönemde hasta ziyaretlerinin sınırlandırılması ve hastalara hastane dışından yiyecek ve içecek getirilmemesine özellikle dikkat edilmesi gerekmektedir. Hastane kurallarına mutlaka uyulmalıdır. Grip / nezle gibi bulaşıcı hastalıkların yaygın olduğu dönemlerde hasta olan hiç kimse hastaneye gitmemelidir. Oda ziyaretine izin verilen hastaların odasına ziyaretçiler sıra ile girmeli ve bir kişiden fazla ziyaretçi aynı anda odada bulunmamalıdır.
Kemik iliği aspirasyon ve biyopsisi nedir, nasıl yapılır? 
Göğüsteki iman tahtası (sternum) ya da kalça kemiğine özel bir iğne ile girilerek kemik iliğinin enjektör yardımı ile alınmasıdır. İliğin alınacağı bölge temizlendikten sonra bölgesel anestezi ile uyuşturulur. Böylelikle hasta ağrı duymaz. Ancak iliğin çekilmesi esnasında vakuma bağlı olarak bir çekilme hissi duyulur. Biyopside ise kemik iliği aspirasyonu gibi kalça kemiğine özel iğne yardımıyla, lokal anestezi altında girilir ve küçük bir örnek alınır.
Şekil: Aspirasyon biyopsisinin yapılışı
Kullanılan ilaçlar kısırlık yapar mı? 
Hastaların çoğu yüksek dozlarda kemoterapiler aldıklarından kısırlık (infertilite) olabilir. Erkek hastalarda tedavi öncesi sperm dondurulması önerilir. Bayan hastalar için durum biraz daha güçtür. Zira yumurta dondurulması işlemindeki başarı oranı çok düşüktür. Embriyo dondurulmasının sonuçları daha iyidir. Ancak ülkemiz yasaları ancak resmi olarak evli çiftlere embriyo dondurma hakkını vermektedir. Daha ayrıntılı bilgi için Genel bilgilere bakınız.
Kaynaklar
Kan Hastalıkları Merak Ettikleriniz Prof. Dr. Ahmet Öztürk
Swerdlow S., Campo E., Lee Haris N., Jaffe E.S., Pileri S., Stein H., Thiele J., Vardiman J.W., WHO classification of tumors of hematopoetic and lymphoid tissues 2008.
Greer j., Foerster j., Rodgers G., Paraskevas F., Glader B., Arber D.A., Means R., Wintrobe’s Clinical Hematology 2009.
Hoffman R., Benz E.J., Shattil S.J., Furie B., Silberstein L.E., McGlave P., Heslop H., Hematology Basic Principles and Practice 2009
|



